Установки прямого электролиза воды представляет собой модульную систему для обеззараживания питьевых и сточных вод, а также окисления примесей воды в системах водоподготовки. Установки прямого электролиза воды работают только в проточном режиме.
Электролизная установка состоит из двух основных элементов:
Электролизёр содержит титановые пластины (электроды) с покрытием из оксидов благородных металлов. В электролизёре из присутствующих в воде хлоридов производится активный хлор, а также при электролизе воды образуются другие окислители (кислород, озон, радикалы).
Производство активного хлора и других окислителей электролизом воды обеспечивает более эффективное обеззараживание и окисление примесей, чем дозирование в воду хлор-газа или гипохлорита натрия.
Блок питания и автоматики снабжен защитными устройствами и микропроцессором контроля работы электролизёра, включая функцию автоматической очистки электродов для предотвращения отложений накипи на электродах.
| Артикул производителя | Прозиводительность по акт.хл.г./ч | Напряжение питающей сети, В | Удельное потребление эл.энергии, КВт*ч | Ресурс электродов | Возможность подключения внешнего управления |
| ЭУ-ПП1Н21.10 | 10 | 380/220 | 0,6 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н22.10 | 10 | 380/220 | 0,6 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н21.25 | 25 | 380/220 | 1,5 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н22.25 | 25 | 380/220 | 1,5 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н21.50 | 50 | 380 | 3 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н22.50 | 50 | 380 | 3 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н21.100 | 100 | 380 | 6 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н22.100 | 100 | 380 | 6 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н21.250 | 250 | 380 | 15 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н22.250 | 250 | 380 | 15 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н21.500 | 500 | 380 | 30 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н22.500 | 500 | 380 | 30 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н21.1000 | 1000 | 380 | 60 | до 9000 | Сигнал 4-20 mA |
| ЭУ-ПП1Н22.1000 | 1000 | 380 | 60 | до 9000 | Сигнал 4-20 mA |
Для применения установки прямого электролиза воды на конкретном объекте следует уточнить её производительность с учётом содержания в воде окисляемых примесей (железо, марганец, сероводород и т.п.), хлоридов и сульфатов, а также необходимую дозу хлора для обеззараживания. После этого определяется необходимое количество установок исходя из производительности объекта.
Следует иметь в виду, что общая производительность установок должна соответствовать максимальному расчётному расходу проходящей через них воды с учётом режима работы системы водоочистки.
Производительность установки при заданной токовой нагрузке зависит от содержания в обрабатываемой воде окисляемых примесей (железо, марганец, сероводород и т.п.), хлоридов и сульфатов, а также от необходимой дозы хлора для обеззараживания.
Установка работает следующим образом. Обрабатываемую воду подают в электролизёр. Включают блок электропитания, и на электролизёр подается постоянный ток. Силу тока подбирают таким образом, чтобы величина остаточного хлора в обработанной воде соответствовала требованиям СанПиН.
Процесс электролиза – это окислительно-восстановительная реакция, возможная только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях для получения чистых газов – водорода и кислорода – проводят электролиз воды.

Содержание
Что такое электролиз
Для осуществления процесса электролиза в раствор или в расплав помещают два электрода, подключённых к противоположным полюсам источника тока. В качестве электродов чаще всего используется металл или графит, так как эти материалы пропускают электрический ток.
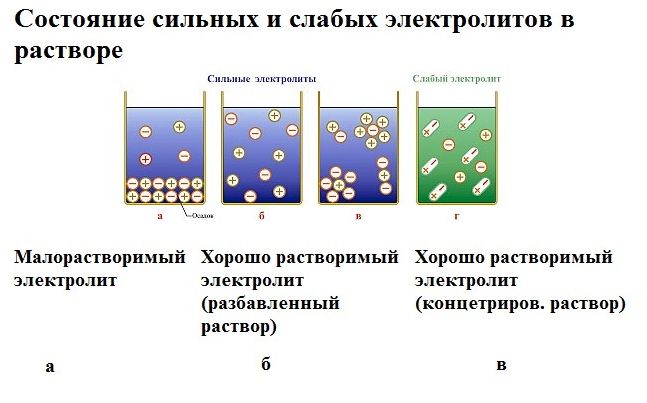
Рис. 1. Электролиты в растворе.
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду – отрицательно заряженные анионы.
Катод является окислителем, на нём происходит процесс восстановления катионов. На аноде протекает процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
- анод: 2H2O → O2 + 4H+ + 4e–;
- катод: 4H+ + 4e– → 2H2.
Или:
- анод: 3H2O → O3 + 6e– + 6H+;
- катод: O2 + 2H2O + 2e– → H2O2 + 2OH–.
Общее уравнение:
2H2O → 2H2 + O2.
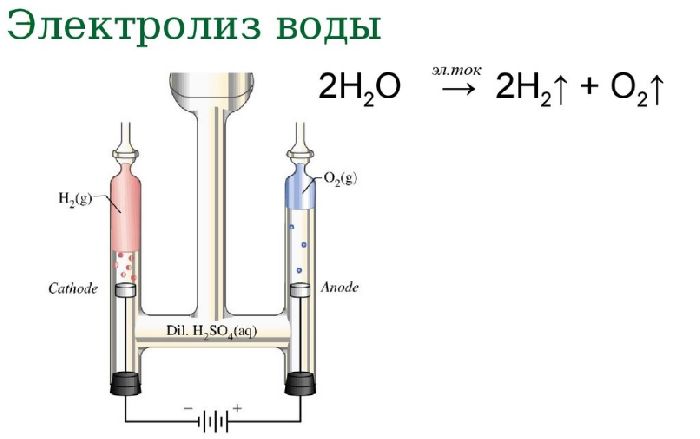
Рис. 2. Схема электролиза воды.
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H+). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H+ воды. На роль катиона электролита подходят:
- Li+;
- Rb+;
- K+;
- Cs+;
- Ba2+;
- Sr2+;
- Ca2+;
- Na+;
- Mg2+.
Для исключения конкуренции анионов, наоборот, подбирают электролит с анионами большего электродного потенциала, чем анион OH– воды. В качестве такого электролита применяется щелочь для образования гидроксильного иона OH–.
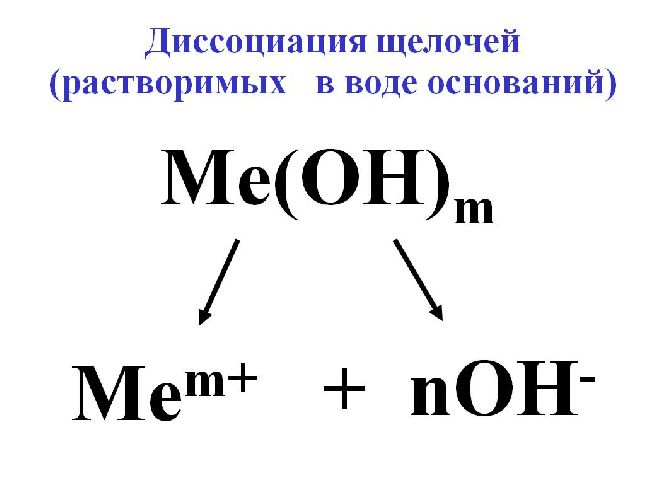
Рис. 3. Диссоциация щёлочи.
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Тест по теме
- Вопрос 1 из 5
К какому электроду движутся катионы?
- К аноду – положительно заряженному электроду
- К аноду – отрицательно заряженному электроду
- К катоду – положительно заряженному электроду
- К катоду – отрицательно заряженному электроду
Начать тест(новая вкладка)